ترمودینامیک مواد
شیمی فیزیک و ترمودینامیک مواد
ترمودینامیک موادکاربرد ترمودینامیک برای مطالعهٔ جامدات (خصوصاً جامدات کریستالی) را ترمودینامیک مواد یا ترمودینامیک جامدات مینامند که یک ابزار کمی قدرتمند برای بررسی خواص مهم مواد است.به عنوان مثال با کمک ترمودینامیک بدون الزام به دانستن جزئیات اتمی کریستالها میتوان ساختار آنها را کنترل کرد. در این حالت نیازی به هیچگونه پیشبینی مدل خاصی برای اتمها نیست و با استفاده از سه قانون ترمودینامیک و بکارگیری روشهای ریاضیاتی میتوان اکثر خواص ماکروسکوپیک را محاسبه کرد.البته کاربرد ترمودینامیک کلاسیک برای مقاصد ترمودینامیک مواد ناکافی است. زیرا به دلیل عمومیت و سادگی ترمودینامیک کلاسیک، هیچ اطلاعاتی در مورد جزئیات روابط بین اتمها و نابجاییها در کریستال نمیتوان بدست آورد. برای بدست آوردن چنین اطلاعاتی باید از مکانیک آماری (ترمودینامیک آماری) استفاده کرد.شیمیفیزیکشیمیفیزیک یا فیزیکشیمی پایهایترین شاخهٔ شیمی است. شاخهای که میتوان قانونگاه شیمی نامید. این علم دارای دانشمندان بنامی چون گیبس، هلمهوتز، آرنیوس، نرنست، شرودینگر و ... میباشد. این علم با فیزیک رابطهای نزدیک دارد. شیمیفیزیک دارای شاخههای زیر میباشد:ترمودینامیکسینتیک شیمیاییالکتروشیمیشیمی کوانتومشیمیفیزیک محاسباتیکاربردهای شیمیفیزیکارتباط شیمیفیزیک با سایر علوم، کاربردهای اقتصادی و اجتماعی این علم را بیان میکند. به عنوان مثال، با مطالعه الکتروشیمی، به پایه و اساس پدیدههای طبیعی مانند خوردگی فلزات پی برده و میتوان از ضررهای اقتصادی و اجتماعی چنین پدیدههایی جلوگیری کرده و یا این پدیدهها را به مسیری مفید برای جامعه سوق داد. علاوه بر آن، کاربرد قوانین ترمودینامیک مانند نقطه یوتکتیک در جلوگیری از ضررهای جانی و مالی پدیدههای طبیعی مانند یخبندان بعد از بارش برف، بسیار مفید میباشد. با توجه به نبودن مرز بين قوانين فيزيك و تحولات شيميايي جايگاه خاص اين بخش از بخش از علم مشخص است.واژگان شیمی فیزیک enthalpy of formation: آنتالپی تشکیل برای یک ماده مرکب معین ، تغییر آنتالپی واکنشی که در آن ، یک مول ماده مرکب از پایدارترین شکلهای عناصر آن تشکیل می شود، آنتالپی تشکیل مینامند. ▪ Hess,lawقانون هس یا قانون جمعبندی ثابت گرما تغییر آنتالپی واکنش شیمیایی ، ثابت است، خواه واکنش در یک مرحله ، خواه در دو مرحله انجام گیرد. ▪ قانون نسبتهای معین یک ماده مرکب خالص ، عناصر یکسان با نسبتهای جرمی یکسان دارد. law of definite propotions ▪ قانون پایستاری جرم در جریان واکنش شیمیایی ، تغییر قابل توجهی نمیکند. ...
دانلود کتاب ترمودینامیک مواد

تالیف: دیوید راگون، ترجمه: دکتر علی حائریان اردکانی و مهندس فاتح فاضلی، سال نشر: 1378 ترمودینامیک که دانش مطالعه انرژی و تبدیل آن به انواع دیگر انرژی است، در تمام زمینه های علوم و مهندسی کاربرد دارد. به طور کلی باید توجه نمود که کتابهای درسی بنیادی ترمودینامیک، برای دانشجویان هر رشته با هدفهای حرفه ای مشخص تدوین نمی شوند، از سوی دیگر بررسی عمومی ترمودینامیک برای اکثر دانشجویان....
ترمودینامیک مواد گسگل

Introduction To The thermodinamics Of MaterialsDavid R. Gaslellشرح : کتاب مقدمه ای برترمودینامیک گسکل یکی از جامع ترین کتب در زمینه شیمی فیزیک و ترمودینامیک مواد است. کاربرد ترمودینامیک برای مطالعه ی جامدات(خصوصاً جامدات کریستالی) را ترمودینامیک مواد می نامند که یک ابزار کمی قدرتمند برای بررسی خواص مهم مواد است.فایل : PDFتعداد صفحات :۳۱۸حجم : ۲۶MB لینک دانلودلینک کمکی مشاهده مطالب مرتبطورود به فروشگاه
ترمودینامیک

ترمودینامیک ترمودینامیک (به انگلیسی: Thermodynamics) شاخه ای از علوم طبیعی است که به بحث راجع به گرما و نسبت آن با انرژی و کار می پردازد. ترمودینامیک متغیرهای ماکروسکوپیک ( همانند دما، انرژی داخلی، آنتروپی و فشار ) را برای توصیف حالت مواد تعریف و چگونگی ارتباط آن ها و قوانین حاکم بر آن ها را بیان می نماید. ترمودینامیک رفتار میانگینی از تعداد زیادی از ذرات میکروسکوپیک را بیان می کند. فوانین حاکم بر ترمودینامیک را از طریق مکانیک آماری نیز می توان بدست آورد. ترمودینامیک موضوع بخش گسترده ای از علم و مهندسی است - همانند : موتور، گذار فاز، واکنش های شیمیایی، پدیده های انتقال و حتی سیاه چاله ها- .محاسبات ترمودینامیکی برای زمینه های فیزیک، شیمی، مهندسی شیمی، مهندسی هوافضا، مهندسی مکانیک، زیست شناسی یاخته، مهندسی پزشکی،دانش مواد و حتی اقتصاد لازم است.عمده مباحث تجربی ترمودینامیک در چهار قانون بنیادی آن بیان گردیده اند: قانون صفرم، اول، دوم و سوم ترمودینامیک. قانون اول وجود خاصیتی از سیستم ترمودینامیکی به نام انرژی داخلی را بیان می کند. این انرژی از انرژی جنبشی که ناشی از حرکت کلی سیستم و انرژی پتانسیل که سیستم نسبت به محیط پیرامونش دارد، متمایز است. قانون اول همچنین دو شیوه انتقال انرژی یک سیستم بسته را بیان میکند : انجام کار یا انتقال حرارت. قانون دوم به دو خاصیت سیستم، دما و آنتروپی، مربوط است. آنتروپی محدودیت ها - ناشی از برگشت ناپذیری سیستم - بر میزان کار ترمودینامیکی قابل تحویل به یک سیستم بیرونی طی یک فرایند ترمودینامیکی را بیان می کند. دما، خاصیتی که با قانون صفرم ترمودینامیک تا حدودی تبیین می گردد، نشان دهنده ی جهت انتقال انرژی حرارتی بین دو سیستم در نزدیکی یکدیگر است. این خاصیت همچنین به صورت کیفی با واژه های داغ یا سرد بیان می گردد.از دیدگاه تاریخی ترمودینامیک با آرزوی افزایش بازده موتورهای بخار گسترش یافت. به ویژه به سبب تلاش های فیزیکدان فرانسوی، نیکولا لئونارد سعدی کارنو که اعتقاد داشت افزایش بازده موتورهای بخار می تواند رمز پیروزی فرانسه در نبردها ناپلئون باشد. فیزیکدان انگلیسی، لرد کلوین، نخستین کسی بود که در سال ۱۸۵۴ تعریفی کوتاه برای ترمودینامیک ارائه داد :« ترمودینامیک عنوان مبحثی است که روابط حاکم بر ارتباط حرارت با نیروهای وارد بر یک پیکر پیوسته و همچنین رابطه بین حرارت با الکتریسیته را بیان می کند. »در ابتدا ترمودینامیک ماشین های بخار به صورت عمده راجع به خصوصیات گرمایی مواد مورد کاربرد- بخار آب - بود. بعدها این مبحث به ...
ترمودینامیک
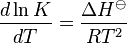
انرژی سلول برای انجام فعالیتهای حیاتی به انرژی نیاز دارد. سنتز ترکیبات بیوشیمیایی، حرکت سلول، انتقال مواد ساختارهای غشایی و تولید از جمله فرآیندهای انرژی خواه محسوب میشوند. سلول انرژی مورد نیاز خود را از واکنشهای شیمیایی بدست میآورد. این همراه با تغییرات انرژی آزاد () هستند که در اختیار سلول قرار میگیرد. C+D A+B : تغییرات انرژی آزاد استاندارد (هنگامیکه غلظت مواد اولیه و محصولات، یک مولار و PH محلول برابر ۷ است). R: ثابت گازها (cal/mol.k 987/1). T: دمای مطلق هنگامیکه واکنش در حالت تعادل کامل باشد، خواهد بود، بنابراین: ۱ـ واکنشهای اگزرگونیک، مقدار keq بیشتر از ۱ و مقدار منفی است. بنابراین واکنش به سمت تشکیل محصولات به پیش میرود. ۲ـ در واکنش اندروگونیک، مقدار keq کمتر از ۱ و مقدارمثبت است. بنابراین واکنش بطور خوبخود انجام نمیشود در این فرایند، غلظت محصولات کمتر از مواد اولیه است. ۳ـ بر اساس مقدار ، نمیتوان خودبخود بودن واکنش را در شرایط درون سلولی پیشگویی کرد. زیرا پیشرفت واکنش همانند ثابت تعادل به غلظت واقعی مواد اولیه در سلول است. و نه منعکس کننده خودبخود بودن واکنشهای درون سلولی است. بعنوان مثال واکنش آلدولاز (در مسیر گلیکولیز)، مقدار حدود ۵۰۰/۵ کالری بر مول و keq معادل ۰۰۱/۰ است واکنش بطور خوبخودی انجام نمیشود و به سمت تشکیل مواد اولیه تمایل دارد. حال اگر غلظت مواد اولیه و محصولات ۱/۰ میلی مولار (غلظت مناسب در سلول) باشد، متعادل ۱۷۳- کالری بر مول خواهد بود و واکنش به سمت تشکیل به پیش میرود. ۴ـ تغییرات انتالپی مبین میزان حرارت تولید شده یا مصرف شده در طی واکنش است. ۵ـ تغییرات انتروپی نشاندهنده تغییر در بینظمی یک سیستم است. هنگامیکه یک بلور نمک حل میشود، یا مولکول در جهت گرادیان غلظت، انتشار مییابد و یا پروتئینی دناتوره میشود، میزان انتروپی افزایش مییابد. ولی هنگامیکه یک مولکول پیچیده از مولکولهای سادهتر ساخته میشود، انتروپی کاهش مییابد. ۶ـ رابطه بین تغییرات انرژی آزاد، انتالپی و انتروپی بشرح زیر است: بیوانرژتیک یا تردمودینامیک بیوشیمیایی به مطالعه تغییرات انرژی در طی واکنشهای حیاتی میپردازد. در این شاخه از علم، اصولی بیان میشود که طبق آن برخی از واکنشها انجام میشوند، در حالیکه امکان انجام بعضی دیگر وجود ندارد. سیستمهای بیولوژیک از قوانین کلی ترمودینامیک تبعیت میکنند. قانون اول ترمودینامیک، قانون بقای انرژی است و بر طبق آن کل انرژی یک سیستم همراه با محیط اطراف آن، همواره مقدار ثابتی است. بر طبق قانون دوم ترمودینامیک، چنانچه فرآیندی بصورت خودبخود ...
دانلود کتاب مقدمه ای بر ترمودینامیک مواد گسکل + حل المسائل
مقدمه ای بر ترمودینامیک مواد David Gaskell -- Introduction to the Thermodynamics of Materials, 4th Edition تالیف : دیوید گسکل حجم : 29,075 کیلوبایت زبان اصلی -- پی دی اف pdf دانلود---------- حل مسائل مقدمه ای بر ترمودینامیک مواد دکتر گسکل حجم : حدود 617 کیلوبایت دانلود مرکز انجمنهاي تخصصي
حل تمرین مقدمه ای بر ترمودینامیک مواد (دیوید گسکل)
حل تمرین ویرایش ۴ مقدمه ای بر ترمودینامیک مواد (دیوید گسکل) Manual solution of an introduction to termodynamics of materials (David Gaskell) توجه کنید که فقط سوالات تا فصل ۱۲ کتاب در این حل وجود دارد.
