ترمودینامیک
انرژی
سلول برای انجام فعالیتهای حیاتی به انرژی نیاز دارد. سنتز ترکیبات بیوشیمیایی، حرکت سلول، انتقال مواد ساختارهای غشایی و تولید از جمله فرآیندهای انرژی خواه محسوب میشوند. سلول انرژی مورد نیاز خود را از واکنشهای شیمیایی بدست میآورد. این همراه با تغییرات انرژی آزاد () هستند که در اختیار سلول قرار میگیرد.
C+D A+B
: تغییرات انرژی آزاد استاندارد (هنگامیکه غلظت مواد اولیه و محصولات، یک مولار و PH محلول برابر ۷ است).
R: ثابت گازها (cal/mol.k 987/1).
T: دمای مطلق
هنگامیکه واکنش در حالت تعادل کامل باشد، خواهد بود، بنابراین:
۱ـ واکنشهای اگزرگونیک، مقدار keq بیشتر از ۱ و مقدار منفی است. بنابراین واکنش به سمت تشکیل محصولات به پیش میرود.
۲ـ در واکنش اندروگونیک، مقدار keq کمتر از ۱ و مقدارمثبت است. بنابراین واکنش بطور خوبخود انجام نمیشود در این فرایند، غلظت محصولات کمتر از مواد اولیه است.
۳ـ بر اساس مقدار ، نمیتوان خودبخود بودن واکنش را در شرایط درون سلولی پیشگویی کرد. زیرا پیشرفت واکنش همانند ثابت تعادل به غلظت واقعی مواد اولیه در سلول است. و نه منعکس کننده خودبخود بودن واکنشهای درون سلولی است. بعنوان مثال واکنش آلدولاز (در مسیر گلیکولیز)، مقدار حدود ۵۰۰/۵ کالری بر مول و keq معادل ۰۰۱/۰ است واکنش بطور خوبخودی انجام نمیشود و به سمت تشکیل مواد اولیه تمایل دارد. حال اگر غلظت مواد اولیه و محصولات ۱/۰ میلی مولار (غلظت مناسب در سلول) باشد، متعادل ۱۷۳- کالری بر مول خواهد بود و واکنش به سمت تشکیل به پیش میرود.
۴ـ تغییرات انتالپی مبین میزان حرارت تولید شده یا مصرف شده در طی واکنش است.
۵ـ تغییرات انتروپی نشاندهنده تغییر در بینظمی یک سیستم است. هنگامیکه یک بلور نمک حل میشود، یا مولکول در جهت گرادیان غلظت، انتشار مییابد و یا پروتئینی دناتوره میشود، میزان انتروپی افزایش مییابد. ولی هنگامیکه یک مولکول پیچیده از مولکولهای سادهتر ساخته میشود، انتروپی کاهش مییابد.
۶ـ رابطه بین تغییرات انرژی آزاد، انتالپی و انتروپی بشرح زیر است:
بیوانرژتیک یا تردمودینامیک بیوشیمیایی به مطالعه تغییرات انرژی در طی واکنشهای حیاتی میپردازد. در این شاخه از علم، اصولی بیان میشود که طبق آن برخی از واکنشها انجام میشوند، در حالیکه امکان انجام بعضی دیگر وجود ندارد.
سیستمهای بیولوژیک از قوانین کلی ترمودینامیک تبعیت میکنند. قانون اول ترمودینامیک، قانون بقای انرژی است و بر طبق آن کل انرژی یک سیستم همراه با محیط اطراف آن، همواره مقدار ثابتی است. بر طبق قانون دوم ترمودینامیک، چنانچه فرآیندی بصورت خودبخود انجام گیرد، آنتروپی سیستم باید افزایش یابد. انتروپی نشاندهنده بینظمی است و هنگامیکه یک سیستم به حالت تعادل میرسد، میزان آنتروپی حداکثر است.
همانطور که گفتیم در یک سیستم با دما و فشار ثابت، رابطه بین انرژی آزاد و انتروپی بصورت زیر است:
تغییر انرژی آزاد، تغییر حرارت یا انتالپی، T درجه حرارت مطلق و تغییر انتروپی سیستم است.
اگر منفی باشد، واکنش بطور خودبخود انجام میشود و انرژیزا است. چنانچه مثبت باشد. واکنش انرژیگیر است و فقط با کسب انرژی آزاد، انجامپذیر است. اگر برابر صفر باشد، سیستم در حالت تعادل بوده و هیچ تغییری صورت نمیگیرد.
هنگامیکه غلظت مواد شرکتکننده در واکنش برابر یک مول باشد، تغییر انرژی آزاد استاندارد متناسب با ضریب ثابت تعادل (Keq) است:
R ضریب ثابت گاز و T دمای مطلق است. چنانچه Keqبیشتر از یک باشد، واکنش بطور خودبخود انجامپذیر است. چنانچه این ضریب کمتر از یک باشد، واکنش در جهت عکس انجام میشود. البته ضریب ثابت تعادل هیچ اطلاعی در مورد سد انرژی بدست نمیدهد و تنها را تعیین میکند.
در شرایط استاندارد، غلظت مواد شرکتکننده در واکنش یک مول و PH برابر ۰/۷ است. در این حالت، تغییر انرژی آزاد استاندارد با علامت نشان داده میشود:
R ضریب ثابت گاز، T درجه حرارت مطلق و است.
انرژی لازم برای انجام فرایندهای حیاتی از طریق برقراری ارتباط شیمیایی یا جفتشده با واکنشهای اکسیداتیو بدست میآید. مهمترین روش برای جفتشدن که فرآیندهای انرژیزا و انرژیگیر، تشکیل ترکیبی با پتانسیل انرژی بالاست. لیپمن با ارائه نظریه فسفاتهای پرانرژی، نقش این ترکیبات را در بیوانرژتیک بخوبی مشخص نمود. این ترکیبات را بر اساس حاصل از هیدرولیز، میتوان به دو دسته تقسیم کرد. فسفاتهای کم انرژی نظیر گلیسرول ۳ فسفات، گلوکز ۶ فسفات و ADP و ۲) فسفاتهای پرانرژی نظیر کراتین فسفات، کرباموئیل فسفات و فسفوانول پرویت. موقعیت واسطهای ATP، نقش مهمی از لحاظ انتقال انرژی به آن میدهد.
در اثر هیدرولیز ATP، انرژی زیادی آزاد میشود که بعلت نیروی دافعه بار الکتریکی اتمهای اکسیژن مجاور و پایدار شده محصولات واکنش (به خصوص فسفات) به صورت هیبریدهای رزنانس است.
سایر ترکیبات مهم بیولوژیک که در گروه ترکیبات پرانرژی قرار میگیرند عبارتند از: استرهای تیول (استیل کوآنزیم A)، پروتئین حامل آسیل (در بیوسنتز اسیدهای چرب)، استرهای آمینواسیدها(در سنتز پروتئین)، S آدنوزیل متیونین، یوریدین دی فسفو گلوکز (UDPGLC) و فسفوریبوزیل پیروفسفات (PRPP).
در سیستمهای بیولوژیک همانند سیستمهای شیمیایی، روند اکسیداسیون (از دست دادن الکترون) همواره با احیای یک پذیرنده الکترون همراه است. در واکشنهای اکسیداسیون ـ احیاء، تغییرات انرژی آزاد را میتوان بصورت پتانسیل اکسیداسیون ـ احیاء یا Redox بررسی کرد. به کمک پتانسیل اکسیداسیون ـ احیای ارائه شده میتوان جهت جریان الکترونها را از یک جفت اکسیداسیون ـ احیاء به جفت دیگر پیشبینی کرد. الکترونها در طول زنجیرهی تنفسی به سمت اکسیژن طی سیر میکنند و پتانسیل اکسیداسیون ـ احیای برابر با ۱۴/۱ ولت را از NAD+/NADH به O2/H2O پشت سر میگذارند.
آنزیمهای دخیل در اکسیداسیون ـ احیاء را اکسیدورودکتاز مینامند که به چهار گروه تقسیم میشوند: اکسیداز، دهیدروژناز، هیدروپراکسیداز و اکسیژناز (جدول ۱ )
۱ـ اکسیدازها: هیدروژن را از سوبسترا جدا کرده و به اکسیژن میافزایند. محصول واکنش، آب یا پراکسید هیدروژن است.
۲ـ دهیدروژنازها: این گروه نمیتوانند از اکسیژن بعنوان پذیرنده هیدروژن استفاده کنند. دهیدروژنازها دو عمل اصلی انجام میدهند: الف) انتقال هیدروژن از یک سوبسترا به سوبسترای دیگر در یک واکنش جفت شده اکسیداسیون احیا.
ب) شرکت در انتقال الکترون از سوبسترا به اکسیژن در طی زنجیره تنفسی.
۳ـ هیدروپراکسیدازها: شامل کاتالاز و پراکسیدازها است که بدن را در مقابل پراکسید هیدروژن اکسیدهای لیپیدی محافظت میکنند.
۴ـ اکسیژنازها: با افزودن اکسیژن به مولکولهای مختلف، موجب سنتز و یا تجزیه متابولیتها میشوند. این آنزیمها به دو زیر گروه زیر تقسیمبندی میشوند: دی اکسیژنازها و منواکسیژنازها.
اگر چه اکسیژن در فرآیند تنفس سلولی و تولید انرژی نقش اساسی دارد، ولی میتواند بطور بالقوه ایجاد مسمویت نماید.
زیرا اکسیژن در طی واکنشهای مختلف به پراکسید هیدروژن تبدیل میگردد و همچنین به راحتی در نسوج مختلف به ریشه آزاد آنیون سوپراکسید () احیاء میشود. آنزیم سوپراکسید دیسموتاز طی واکنش زیر آنیون سوپراکسید را از بین میبرد:
این آنزیم در تمام نسوج موجودات هوازی وجود دارد و از عوارض بالقوه خطرناک سوپراکسید جلوگیری میکند.
معادله وانتهف(به انگلیسی: Van 't Hoff equation) یک معادله زمینه ترمودینامیک شیمیایی است که رابطهای بین تغییرات دما و تغییرات ثابت تعادل تغییرات٬ آنتالپی استاندارد را میدهد که اولین بار توسط جاکوبس هنریکوس وانتهف (به انگلیسی: Jacobus Henricus van 't Hoff) ارائه شده است.
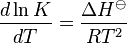
که آن را به صورت زیر هم میتوان نوشت.
 [۱]
[۱]اگر تغییرات آنتالپی در دو واکنش برابر باشد انتگرال معین رابطه به ما میدهد:

که در این معادله K1 ثابت تعادل در دمای مطلق T1 و K2 ثابت تعادل در دما مطلق T2 است وR ثابت عمومی گازها و ΔHo تغییرات آنتالپی است. از روی قوانین ترمودینامیک شیمیایی(قانون انرژی آزاد گیبس ) این فرمولها معوم میشوند:

و

پس ثابت تعادل از فرمول زیر بدست میآید.

مطالب مشابه :
شیمی فیزیک و ترمودینامیک مواد
ریخته گری متالورژی ذوب فلزات مواد - شیمی فیزیک و ترمودینامیک مواد - مرجع فیلم و انیمیشن
دانلود کتاب ترمودینامیک مواد
مهندس محمدرضا فروغی - دانلود کتاب ترمودینامیک مواد - ارتباط دوسویه با دانشجویان دانشگاه
ترمودینامیک مواد گسگل
پر بازدید ترین وب سایت مهندسی مواد. وب سایت مهندسین مواد ایران. موضوعات
ترمودینامیک
آزمایشگاه فیزیک 2 - ترمودینامیک - تحقیق و پژوهش فیزیک ترمودینامیک مواد ترمودینامیک
ترمودینامیک
حال اگر غلظت مواد اولیه و محصولات ۱ سیستمهای بیولوژیک از قوانین کلی ترمودینامیک تبعیت
دانلود کتاب مقدمه ای بر ترمودینامیک مواد گسکل + حل المسائل
انجمن علمی متالورژی دانشگاه آزاد کرج - دانلود کتاب مقدمه ای بر ترمودینامیک مواد گسکل + حل
حل تمرین مقدمه ای بر ترمودینامیک مواد (دیوید گسکل)
متالورژهای دانشگاه صنعتی اصفهان - حل تمرین مقدمه ای بر ترمودینامیک مواد (دیوید گسکل) - Isfahan
برچسب :
ترمودینامیک مواد
